Category:Method/Sample/PL/Oxidized: Difference between revisions
No edit summary |
|||
| Line 1: | Line 1: | ||
=Oxidized phospholipids= | =Oxidized phospholipids= | ||
{{Twocolumn| | {{Twocolumn| | ||
# Samples were homogenized with 1mL methanol and extracted for 1 h at on ice. | # Samples(100mg) were homogenized with 1mL methanol and extracted for 1 h at on ice. | ||
# Homogenates were centrifuged (7000 rpm, 4 ◦C, 5min). | # Homogenates were centrifuged (7000 rpm, 4 ◦C, 5min). | ||
# Supernatant was diluted with 10 volumes of water adjusted to pH 3.0 with 0.1N HCl. | # Supernatant was diluted with 10 volumes of water adjusted to pH 3.0 with 0.1N HCl. | ||
| Line 9: | Line 9: | ||
# Lipid extracts were dried under a gentle stream of nitrogen, dissolved in 1mL of methanol, and stored at −80 ◦C until use. | # Lipid extracts were dried under a gentle stream of nitrogen, dissolved in 1mL of methanol, and stored at −80 ◦C until use. | ||
| | | | ||
# | # 組織(100mg)をメタノール 1mL でホモジナイズ、氷上で1時間放置し脂質を抽出 | ||
# 遠心分離 (7000 rpm, 4 ◦C, 5min) | # 遠心分離 (7000 rpm, 4 ◦C, 5min) | ||
# 上清を 0.1N HClでpH 3.0に調整した10倍量の水で希釈 | # 上清を 0.1N HClでpH 3.0に調整した10倍量の水で希釈 | ||
Revision as of 06:59, 26 October 2010
Oxidized phospholipids
|
|
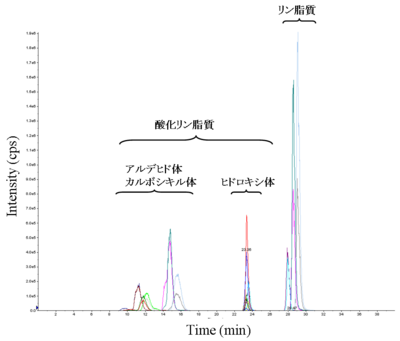
図4 逆相LCによるリン脂質・酸化リン脂質の分離 |
分析にかける前に逆相カラムを使うことで、生体内で量的に多いリン脂質と量的に少ない酸化リン脂質が分離できる。これにより、ある程度のイオン化抑制を回避した高感度測定が可能となる。なお、酸化リン脂質の中でもアルデヒド体、カルビキシル体とヒドロキシ体はきれいに分離できる。 |
Pages in category "Method/Sample/PL/Oxidized"
This category contains only the following page.